Справочник по физике для ОГЭ.
Тепловые явления (коды ОГЭ 2.1 — 2.11)
СОДЕРЖАНИЕ:
2.1. Молекула – мельчайшая частица вещества. Агрегатные состояния вещества. Модели строения газов, жидкостей и твёрдых тел
2.2. Тепловое движение атомов и молекул. Связь температуры вещества со скоростью хаотического движения частиц. Броуновское движение. Диффузия. Взаимодействие молекул
2.3. Тепловое равновесие
2.4. Внутренняя энергия. Работа и теплопередача как способы изменения внутренней энергии
2.5. Виды теплопередачи: теплопроводность, конвекция, излучение
2.6. Нагревание и охлаждение тел. Количество теплоты. Удельная теплоёмкость
2.7. Закон сохранения энергии в тепловых процессах. Уравнение теплового баланса
2.8. Испарение и конденсация. Изменение внутренней энергии в процессе испарения и конденсации. Кипение жидкости. Удельная теплота парообразования
2.9. Влажность воздуха
2.10. Плавление и кристаллизация. Изменение внутренней энергии при плавлении и кристаллизации. Удельная теплота плавления
2.11. Тепловые машины. Преобразование энергии в тепловых машинах. Внутренняя энергия сгорания топлива. Удельная теплота сгорания топлива
Вы смотрели Справочник по физики «Тепловые явления (коды ОГЭ 2.1 — 2.11)». Выберите дальнейшее действие:
- Перейти в Кодификатор ОГЭ по физике
- Перейти к Оглавлению Справочника ОГЭ по физике (Степанова и др.)
- Купить Справочник ОГЭ по физике (Степанова и др.)
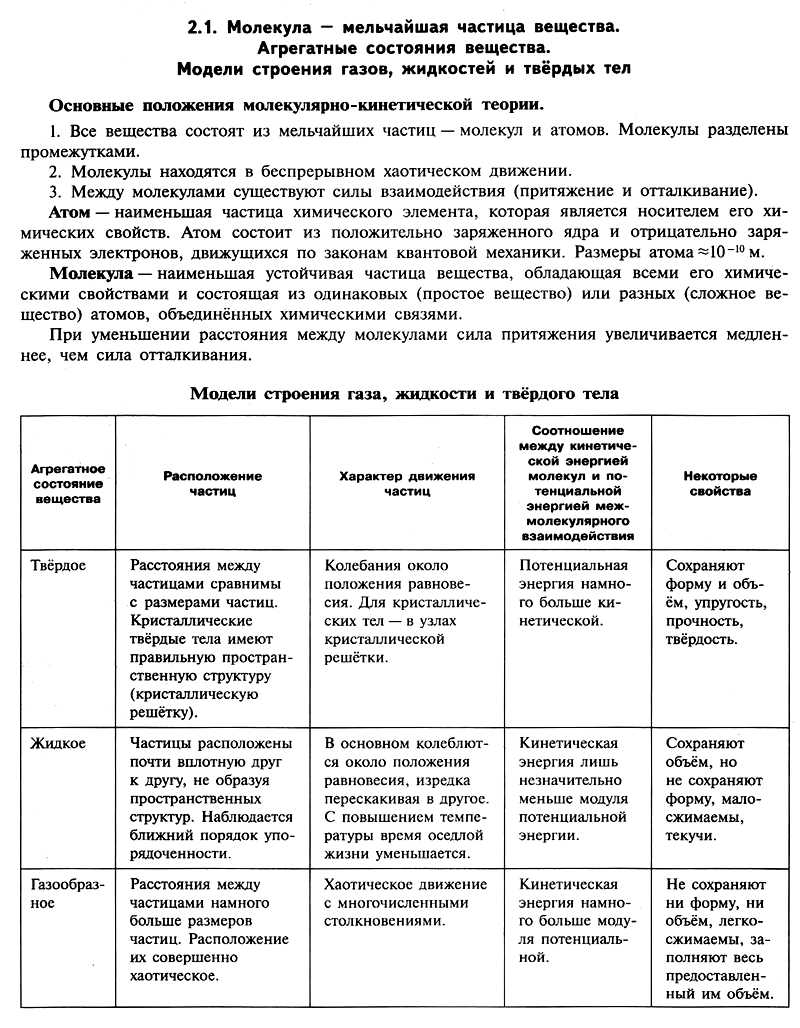
2.1. Молекула – мельчайшая частица вещества. Агрегатные состояния вещества. Модели строения газов, жидкостей и твёрдых тел. Основные положения молекулярно–кинетической теории.
1. Все вещества состоят из мельчайших частиц – молекул и атомов. Молекулы разделены промежутками.
2. Молекулы находятся в беспрерывном хаотическом движении.
3. Между молекулами существуют силы взаимодействия (притяжение и отталкивание).
Атом – наименьшая частица химического элемента, которая является носителем его химических свойств. Атом состоит из положительно заряженного ядра и отрицательно заряженных электронов, движущихся по законам квантовой механики. Размеры атома ~ 10–10 м.
Молекула – наименьшая устойчивая частица вещества, обладающая всеми его химическими свойствами и состоящая из одинаковых (простое вещество) или разных (сложное вещество) атомов, объединённых химическими связями.
При уменьшении расстояния между молекулами сила притяжения увеличивается медленнее, чем сила отталкивания.
2.2. Тепловое движение атомов и молекул. Связь температуры вещества со скоростью хаотического движения частиц. Броуновское движение. Диффузия. Взаимодействие молекул
Молекулы находятся в беспрерывном хаотическом движении
(одно из основных положений молекулярно–кинетической теории). Интенсивность теплового движения увеличивается с повышением температуры.
Тепловое движение атомов и молекул вещества – особая форма движения материи.
Броуновское движение – беспорядочное движение мелких частиц, взвешенных в жидкости или газе, происходящее под влиянием теплового движения молекул жидкости. Является одним из доказательств положения молекулярно–кинетической теории о непрерывном хаотическом тепловом движении молекул.
Броуновское движение никогда не прекращается и усиливается с ростом температуры.
Диффузия – явление наблюдается при наличии контакта двух разнородных веществ и состоит в самопроизвольном проникновении частиц одного вещества в промежутки между частицами другого. Скорость диффузии зависит от температуры и агрегатного состояния вещества (быстрее в газах). Является одним из доказательств первых двух положений молекулярно-кинетической теории.
2.3. Тепловое равновесие
Состояние термодинамической системы, в которое она самопроизвольно приходит через достаточно большой промежуток времени в условиях изоляции от окружающей среды, называется тепловым равновесием.
В этом состоянии параметры системы не изменяются со временем, то есть в системе не меняются объём и давление, не происходит теплообмен, отсутствуют превращения газов, жидкостей и твёрдых тел. В состоянии теплового равновесия температура во всех частях термодинамической системы одинакова.
Температура является мерой средней кинетической энергии движения молекул.
Микроскопические процессы внутри тела в состоянии теплового равновесия не прекращаются: меняются положения молекул, их скорости при столкновениях.
Температуры тел, находящихся в тепловом контакте, выравниваются. На этом явлении основан принцип измерения температуры термометром.
Измерение температуры:
1) тело необходимо привести в тепловой контакт с термометром;
2) термометр должен иметь массу значительно меньше массы тела;
3) показание термометра следует отсчитывать после наступления теплового равновесия.
Температура может быть выражена в единицах различных шкал.
Шкала Цельсия. За О °С взята температура плавления льда при нормальном атмосферном давлении, за 100 °С – температура парообразования воды при нормальном атмосферном давлении: [/] = °С.
Абсолютная шкала температур (шкала Кельвина). Температурная шкала, в которой за ноль принимается температура Т, при которой прекращается тепловое движение молекул.
Единица измерения абсолютной температуры в СИ – кельвин (К): [7] = К.
Связь между абсолютной температурой и температурой по шкале Цельсия: 7’=Г°С + 273.
2.4. Внутренняя энергия. Работа и теплопередача как способы изменения внутренней энергии.
Сумма кинетических энергий хаотического теплового движения всех частиц тела (молекул, атомов) относительно центра масс этого тела и потенциальных энергий взаимодействия молекул и атомов друг с другом называется внутренней энергией тела (U).
Кинетическая энергия теплового движения частиц определяется скоростью их хаотического движения, а значит, температурой тела. Потенциальная энергия зависит от расстояния между частицами, а значит, зависит от объёма тела. Следовательно, внутренняя энергия тела зависит от объёма и температуры: U–U{Tf У).
При нагревании тела его внутренняя энергия увеличивается, а при охлаждении уменьшается. Процесс изменения внутренней энергии тела без совершения работы называется теплопередачей (теплообменом).
Энергию, переданную от одного тела к другому при теплообмене, называют количеством теплоты (Q): [Q] = Дж.
При контакте тел с разной температурой более горячее тело отдаёт некоторое количество теплоты, а более холодное тело её получает.
Способы изменения внутренней энергии: 1) совершение работы; 2) теплопередача.
При осуществлении первого из этих способов внутренняя энергия тела изменяется на величину совершённой работы А, а при осуществлении второго из них – на величину, равную количеству переданной теплоты Q.
2.5. Виды теплопередачи: теплопроводность, конвекция, излучение
Процесс изменения внутренней энергии без совершения работы называется теплопередачей (теплообменом).
Виды теплопередачи.
1. Теплопроводность – вид теплопередачи, при котором энергия передаётся от более нагретого участка тела к менее нагретому благодаря движению и взаимодействию частиц тела. При теплопроводности вещество не перемещается от одной части тела к другой.
2. Конвекция – вид теплопередачи, при котором энергия переносится потоками (струями) вещества. Этот вид теплопередачи может наблюдаться в жидкостях и газах.
3. Излучение – вид теплопередачи, при котором энергия переносится электромагнитными волнами. Может происходить и в вакууме.
2.6. Нагревание и охлаждение тел. Количество теплоты. Удельная теплоёмкость
Если телу массой т передать некоторое количество теплоты Q, его температура изменится. Изменение температуры связано с переданным количеством теплоты следующим соотношением: Q = cm (t% – t°), где с – удельная теплоёмкость вещества, из которого изготовлено тело.
Удельная теплоёмкость с вещества показывает, какое количество теплоты необходимо для нагревания 1 кг данного вещества на 1 К или на 1 °С: [с] = Дж/(кг • К) = Дж/(кг • °С);
При теплообмене количество теплоты считается положительным, если оно поглощается (передаётся телу от нагревателя) телом (нагревание, плавление, испарение). Количество теплоты отрицательно, если оно выделяется (отводится холодильнику) в окружающую среду (охлаждение, кристаллизация, конденсация).
Поглощение энергии телом: Q > 0.
Выделение энергии телом: Q < 0.
2.7. Закон сохранения энергии в тепловых процессах. Уравнение теплового баланса
Изменение внутренней энергии системы при переходе её из одного состояния в другое равно сумме работы внешних сил и количества теплоты, переданного системе.
При любых процессах, происходящих в замкнутой системе (в системе, изолированной от внешних воздействий), её внутренняя энергия остаётся неизменной.
Уравнение теплового баланса: Если между телами, образующими замкнутую термодинамическую систему, происходит теплообмен, то алгебраическая сумма (с учётом знаков) количества теплоты равна нулю. Всё переданное в результате теплообмена количество теплоты равно по модулю всему полученному в результате теплообмена количеству теплоты.
Количество слагаемых в уравнении теплового баланса равно количеству процессов, происходящих в системе при теплообмене: Количество теплоты, отданное при теплообмене более нагретыми телами, равно по модулю количеству теплоты, полученному менее нагретыми телами:
2.8. Испарение и конденсация. Изменение внутренней энергии в процессе испарения и конденсации. Кипение жидкости. Удельная теплота парообразования
Конденсация – процесс перехода вещества из газообразного состояния в жидкое.
Парообразование – процесс перехода вещества из жидкого состояния в газообразное при кипении жидкости.
Испарение – парообразование, происходящее со свободной поверхности жидкости. Испарение может происходить при любой температуре.
Кипение – процесс активного парообразования во всём объёме жидкости. Сопровождается образованием и ростом пузырьков пара внутри жидкости. Пузырьки образуются около центров парообразования (примеси, микротрещины). Рост пузырьков начинается после того, как давление пара внутри пузырька станет равным давлению окружающей жидкости: Условие подъёма пузырька: Fa > mg.
Температура, при которой наблюдается кипение жидкости, называется температурой кипения.
Температура кипения определяется: 1) родом жидкости; 2) внешними условиями, в частности атмосферным давлением или давлением газа внутри закрытого сосуда. С понижением атмосферного давления температура кипения понижается.
Во время кипения температура жидкости и пара над ней не меняется. Температура не меняется до тех пор, пока вся жидкость не выкипит.
Кипение жидкости происходит только при постоянном притоке теплоты к жидкости, находящейся при температуре кипения.
Физическая величина L, показывающая, какое количество теплоты необходимо для превращения 1 кг жидкости в пар при постоянной температуре, называется удельной теплотой
парообразования: L = [L]= Дж/кг.
При парообразовании количество теплоты поглощается, при конденсации – выделяется: где «+» –парообразование, «–» –конденсация.
2.9. Влажность воздуха.
Вещество в газообразном состоянии, находящееся в динамическом равновесии со своей жидкостью, называется насыщенным паром. Динамическим равновесием является состояние, при котором число молекул, покидающих жидкость, равно числу молекул, возвращающихся в жидкость за то же время.
Основные свойства насыщенного пара любой жидкости:
– давление насыщенного пара зависит от температуры (при возрастании температуры давление насыщенного пара увеличивается);
– давление насыщенного пара при постоянной температуре не зависит от объёма.
Влажность воздуха – физическая величина, характеризующая состояние водяного пара
(плотность или давление пара), находящегося в воздухе, по сравнению с состоянием насыщенного пара (плотность или давление насыщенного пара) при той же температуре.
Относительной влажностью воздуха называется отношение плотности пара (рп) к плотности (рн) насыщенного водяного пара при той же температуре, выраженное в процентах: Ф = , [р] = кг/м3.
Приборы для измерения влажности: 1) волосной гигрометр; 2) жидкостный (конденсационный) гигрометр; 3) гигрометр психрометрический (психрометр).
2.10. Плавление и кристаллизация. Изменение внутренней энергии при плавлении и кристаллизации. Удельная теплота плавления
Переход вещества из твёрдого состояния в жидкое называется плавлением. Переход из жидкого состояния в твёрдое называется кристаллизацией.
В процессе плавления и кристаллизации кристаллического вещества его температура не изменяется.
Температура, при которой вещество плавится или кристаллизуется, называется температурой плавления.
Физическая величина, показывающая, какое количество теплоты необходимо для превращения при температуре плавления 1 кг кристаллического вещества в жидкость, называется
удельной теплотой плавления (А.): [А,] = Дж/кг.
Плавление происходит, если при температуре плавления телу непрерывно передаётся некоторое количество теплоты (она поглощается), при кристаллизации при температуре плавления необходимо обеспечить постоянный отток теплоты (она выделяется): Q=±Xm, где «+» – плавление, «–» – кристаллизация.
2.11. Тепловые машины. Преобразование энергии в тепловых машинах. Внутренняя энергия сгорания топлива. Удельная теплота сгорания топлива
Машины, преобразующие внутреннюю энергию в механическую работу, называют тепловыми машинами (двигателями). Основные элементы тепловой машины: тело, нагреватель, холодильник.
Нагреватель передаёт рабочему телу количество теплоты Qv Рабочее тело совершает полезную механическую работу А’ (например, газ – расширяется).
Отработавшее рабочее тело передаёт холодильнику (охладителю) некоторое количество теплоты Q2 и возвращается в исходное состояние, обеспечивая циклический процесс. Полезная работа, произведённая машиной за цикл, равна разности количества теплоты, полученного рабочим телом, и количества теплоты, отданного холодильнику:
Коэффициент полезного действия теплового двигателя равен отношению полезной работы, совершаемой рабочим телом за цикл, к полученному от нагревателя за цикл количеству теплоты:
Существуют разные виды тепловых двигателей: паровая машина, двигатель внутреннего сгорания, газовая и паровая турбины, реактивный двигатель.
В каждом из этих двигателей энергия топлива сначала переходит в энергию газа (или пара), который затем, расширяясь, совершает работу. В процессе совершения этой работы часть внутренней энергии газа превращается в механическую энергию движущихся частей двигателя.
В нагревателе теплового двигателя при сжигании топлива выделяется некоторое количество теплоты. Каждый вид топлива характеризуется удельной теплотой сгорания – физической величиной q, которая показывает, какое количество теплоты выделяется при полном сгорании 1 кг этого вида топлива. Если сгорает т кг топлива, то рассчитать выделившееся количество теплоты можно по формуле Q = qm, [q]= Дж/кг, числовые значения удельной теплоты сгорания разных видов топлива представлены в справочных материалах к экзамену.